エントロピーと相当温位
相当温位は空気中の水蒸気を水や氷にして、その潜熱で乾燥空気を温め1000hPaまで断熱変化させた温度なのですが、その
計算は複雑で分かりにくいものです。
原因はエントロピーを使って相当温位を使って定義しているにもかかわらず、エントロピーを隠しているからです。
ここでは、エントロピーから相当温位を計算してみます。
1.理想気体のエントロピー
まず、理想気体のエントロピーについて復習しておきましょう。
nモル個の理想気体の内部エネルギーは次のように表せます。
U=n
cv
T (1-1)
温度は粒子の平均運動エネルギーに比例し、内部エネルギーは粒子の運動エネルギーを足し合わせたものです。
さて、nモル個の理想気体にδQの熱量を加えてやるとδQは内部エネルギーを増やすことと膨張して仕事をすることにつかわれます
教科書では次のように書かれます
dU=δQー
PdV
(1-2)
(1-1)から(1-2)は
δQ=n cvdT+PdV
(1-3)
δQ/Tとして準静的過程(可逆過程)を考えると
dS=δQ/T (1-4)*
とエントロピーが定義されます。
*熱力学 横田伊佐秋著 岩波書店 P52~P54などを参照
ですから理想気体のエントロピーは(1-3)をTで割って
dS=ncv
dT/T+PdV/T
(1-5)
理想気体の状態方程式も成り立ちますから3変数を2変数にします
すると(1-5)のdSは次の3つの式で表せます
dS=ncv
dT/T
+ nR
dV/V
(1-5...1)
dS=ncv
dP/P
+ ncp
dV/V (1-5...2)
dS=ncp
dT/T
ー nR
dP/P (1-5...3)
相当温位をエントロピーから理解するには
(1-5...3)の関係式が必要ですので、気象を勉強する学生サンは計算して下さい。
もうひとつエントロピーの必要な知識ですが・・;
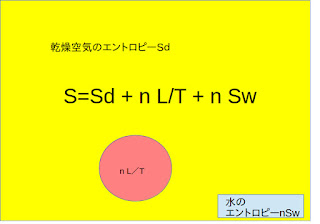
記述が煩雑になりますので、乾燥空気は1モル水蒸気はnモルとします。
空気のエントロピーSは乾燥空気のエントロピーSdと水蒸気のエントロピーn
Seの和
で表せます。
S=Sd+n
Se
(1-6)
2.エントロピーによる温位の計算
まず、温位を計算しておきます。
(1-5...3)を1モルの乾燥空気のエントロピーSdに適用して
dSd
=cp
dT/T
ー nR
dP/P
dSd
=cp
{dT/T
ー R/cp
dP/P}=ncp
{ln
T/P
R/cp
}
積分すると
Sd=
cp
ln
T/P
R/cp + Const
(2-1)
1000hPaまで準静的断熱変化させた時の温度をθエントロピーをS1000とします。
準静的断熱変化ではエントロピーはかわりませんから、
・・と言うよりエントロピーが変わらないように変化させるのですけど・・;
Sd=S1000
Sd
=
cp
ln
T/P
R/cp+ Const
S1000
=
cp
ln
θ/(1000)
R/cp+ Const
∴ θ/(1000)
R/cp=
= T/P
R/cp
(2-2)
θ=T(1000/P
)R/cp (2-3)
このように温位はエントロピーから求められるのですね。
何故?エントロピーを隠すのでしょうね?熱力学が嫌いなのでしょうね・・
ところで、乾燥空気の等エントロピー=等温位は、乾燥断熱減率が必然になります。
3.エントロピーによる相当温位の計算
空気のエントロピーは乾燥空気のエントロピーと水蒸気のエントロピーの和でした
S
= Sd
+ n
Se
教科書では、飽和湿潤空気を断熱膨張させるとしていますが・・
「湿潤空気塊を断熱膨張させる」とはSを変えないよう水蒸気を水することです。
蛇足ですけど
言葉も正しくないのですね・・;準静的断熱膨張に自由膨張を組み合わせても断熱膨張であることには変わりません。
しかしSが変わってしまいます。
しかし、水蒸気は理想気体ではありませんから(1-5)の定義式は使えません・・
?どうしたらよいのか・・?
クラジウスークラペイロンの公式なるものがあります (^^;
熱力学 横田伊佐秋著 岩波書店 P91などを参照
水蒸気から液体の水への転移熱(潜熱のことですね)1モルについてLとすると
⊿S=SeーSw=L/T
となります。
気象を勉強する学生さんは必修です。
忘れても、教科書を開けばすぐ思い出すくらいにはなって下さい。
クラジウスークラペイロンを知らないのはモグリです。
Seは水蒸気のエントロピーSwは水のエントロピーです
簡単ですね水蒸気のエントロピーは
Se=L/T
+
Sw
ですので
n
Swは小さいとして無視され、大気中から取り除き
S
= Sd
+ n
L/T
(3-1)
乾燥空気のエントロピーは(2-1)から
Sd=
cp
ln
T/P
R/cp +
Const
でしたので
S=
cp
ln
T/P
R/cp + Const
+ n
L/T (3-2)
となります。
水を捨て去ったあとで1000hPaまで準静的断熱変化させた時の温度をθe、エントロピーをS’1000とします。
準静的断熱変化ではエントロピーはかわりませんから
Sd=S’1000
Sd
=
cp
ln
T/P
R/cp+ Const
+
n
L/T
(2-2)を使うと
Sd
=
cplnθ/(1000)
R/cp
+
n
L/T
+
Const
また、
S’1000
=
cp
ln
θe/(1000)
R/cp+ Const
計算が少し煩雑ですがガマンしてください,多分高校生でもできる計算です
ln
θe/(1000)
R/cp=
lnθ/(1000)
R/cp
+
n
L/cp
T
=
lnθ/(1000)
R/cp
+
ln
exp( nL/T)
= ln θ
exp( nL/T)/(1000)
R/cp
∴ θe=θ
exp( n L/T)
(3-3)
(3-2)(3-3)は大気科学講座2(P21)の(2.31)(2.32)に対応するところです。
(2.31)の導出過程は、「こんなことして良いのか?」と思ったような..?
さて、水蒸気の量nモルがまだわかりませんね。
これは分圧の法則から
n=Pe/P=Pe/(Pd
+
Pe)
で求めることができます
乾燥空気が1モルじゃないと記述が複雑になることがわかると思います(^^;
う〜〜ん? 相当温位を求めるに温位を使うのは見難いしすっきりしません。
個人的な趣味の問題ではありますが・・;
(3-2)を書きかえましょう。
S
= cp
ln
T/P
R/cp + Const
+ n
L/T
=
cp
ln
T/P
R/cp + cp
ln exp( nL/cpT
) + Const
=cp
ln{
T/P
R/cp
exp( nL/cpT
)} + Const
エントロピーを変えなければよいので次のようなT’があるはずです。
S=cp
ln
T'/P
R/cp
+ Const (3-4)
(実質的に定圧膨張を考えることになります)
T’/P
R/cp
=T/P
R/cp
exp( nL/cpT
)
とりあえずnL/cpT
は小さいとしましょう。(nは水蒸気圧/全圧 n=Pe/Pです)
T’=T
exp( nL/cpT
)〜T(1+
nL/cpT)=T+nL/cp
T’=T+nL/cp (3-4)
T’は明らかに定圧でnL/cpの熱を加えた温度で「相当温度」と言うようです
ここから1000hPaに準静的に断熱変化させた温度をθeとするとエントロピーは変わりませんので
cp
ln
θe/(1000)
R/cp
=
cp
ln
T’/P
R/cp
∴
θe
=T’(1000/P)R/cp (3-5)
4.エネルギー保存則
cp T + mgh = const
を導きました。
乾燥空気は上空と下層(地表)の「cp
T
+ mgh」が同じって意味です。*
結論は
「500hPaと850hPaの空気を比べるには、乾燥断熱減率で地表まで下ろして比べればよい」
でした。
温位は位置エネルギーを無視していますので温位で比べるのは誤りです。
なんとなく、同じ1000hPaにすれば比べられる気がしますが・・根拠が無いのですね。
さて湿潤空気では
cp T + mgh + L e/P = const (4-1)
これが成り立っていれば良さそうです。
次のグラフは偶然、観測時間に台風が来たものです。
湿度20000m近くまでほぼ湿度100%で15000mまで等エントロピーになっています。
上空まで湿潤する大気は台風や沿岸前線で見られます。
台風のような激しい現象でも等エントロピーになろうとするのですね・・
では、
何故、ふだんは等エントロピーになっていないのか?
湿潤していなければ等温位で乾燥断熱減率になるはずなのです・・?
晴れていれば、日中は地上から850hPaくらいまで等温位=等エントロピーになります。
台風は上昇流があるでしょうし、晴れていれば太陽からのエネルギーがはいります。
平衡とはほど遠いと思える台風や晴天で、等エントロピーになるのは何故でしょう?
どうも、自然は等エントロピーになるように(エントロピーの増大則)運動が起こると言うことみたいです。(アタリマエか?)
エントロピーを解釈するのは難しい・;
普段、等エントロピーになっていないのは何かのエントロピーを見逃しているのかもしれません。
例えば、空に浮かんで見える雲のエントロピーはどのくらいでしょう?
小さな泡状で空間に分布していたら、かなりエントロピーは大きい気がします。**
*金星は等温位となっています。
金星の重力g’は地球gより少し小さいでしょうけど、大気はCO2が中心で平均分子量m’は地球のmより少し大きいでしょう。
結果、
乾燥断熱減率は地球に近いと考えられますから、雲から出発すれば100m毎に1℃程度上がります。雲の高さが50kmもありますから地表の温度が高温であるのは当然ですね。
温室効果を信じるゾンビ学生なんかにはならないで下さいね(^^)
放射冷却を信じるなんてPuバイターですよ
放射冷却を信じるなんてPuバイターですよ
**粒状では質量密度が高くて大気中から落下してしまいます。
泡状で中に高温位の空気を取り込んでいれば浮力を得ることができます。
地球の大気は上空に行くほど温位が高く質量密度が小さくなっています。
泡状なら下降して断熱圧縮しても周辺の質量密度が大きく泡は浮力を受けます。
ブツブツ・・
大気って鉛直方向に混ざりにくい構造をしているのですね。
普段は予想しやすい構造なのですが、台風のように鉛直方向に等エントロピーになる予想は苦手なんですよ。
リハビリは続くか?終わりか?はたまた、また落ち込むか?